ĐỊNH LUẬT BEER - LAMBERT
1. Định nghĩa
- Định luật Beer-Lambert là một nguyên tắc cơ bản trong hóa học phân tích liên quan đến sự suy giảm ánh sáng với các tính chất của vật liệu mà ánh sáng đi qua. Khi một ánh sáng đơn sắc có cường độ ban đầu (Io) truyền qua một bình trong suốt chứa dung dịch thì một phần ánh sáng bị hấp thụ làm cường độ của ánh sáng truyền qua (I) giảm đi.
- Sự suy giảm ánh sáng có thể xảy ra do nhiều yếu tố khác nhau như sự tán xạ của các hạt trong dung dịch, sự phản xạ tại các mặt phân cách và đáng kể nhất là sự hấp thụ của chính dung dịch. Mối quan hệ giữa cường độ ánh sáng truyền qua (I) và cường độ ánh sáng ban đầu (Io) phụ thuộc vào hai yếu tố chính: độ dài đường truyền (l) của môi trường hấp thụ và nồng độ (c) của dung dịch hấp thụ. Những yếu tố này được mô tả chính xác bởi định luật Lambert và Beer.
- Định luật Beer-Lambert phát biểu rằng năng lượng được hấp thụ hoặc truyền bởi một dung dịch tỷ lệ thuận với độ hấp thụ mol của dung dịch và nồng độ của chất tan. Định luật này được sử dụng rộng rãi trong hóa học phân tích để đo độ hấp thụ của các mẫu khác nhau. Nó kết hợp các nguyên tắc của Định luật Beer và Định luật Lambert để cung cấp sự hiểu biết toàn diện về sự suy giảm ánh sáng thông qua một chất và các tính chất liên quan của nó.
- Việc áp dụng Luật Beer-Lambert trải rộng trên nhiều lĩnh vực khác nhau, bao gồm dược phẩm và phân tích hóa học hữu cơ. Nó làm sáng tỏ mối quan hệ trực tiếp giữa độ dài đường đi và nồng độ của mẫu được nghiên cứu và độ hấp thụ của tia sáng tới. Bằng cách sử dụng luật này, các nhà khoa học và nhà phân tích có thể xác định nồng độ của chất tan trong dung dịch bằng cách đo độ hấp thụ của nó.
- August Beer là người đầu tiên phát biểu Định luật Lambert-Beer, được biểu diễn dưới dạng toán học I = Ioe^(-μx), trong đó I đại diện cho cường độ ánh sáng truyền qua, Io là cường độ ánh sáng ban đầu, μ là hệ số hấp thụ mol, và x là độ dài đường đi qua môi trường hấp thụ.
- Tóm lại, Định luật Beer-Lambert là một nguyên lý cơ bản giải thích mối quan hệ giữa độ suy giảm của ánh sáng đi qua một chất và các tính chất của chất đó. Nó tìm thấy ứng dụng rộng rãi trong hóa học phân tích, cho phép các nhà khoa học đo độ hấp thụ của mẫu và xác định nồng độ chất hòa tan trong dung dịch.
Luật Beer-Lambert quy định rằng: Độ hấp thụ của dung dịch tỷ lệ thuận với nồng độ, hệ số hấp thụ mol và hệ số quang học của nó.
Định luật Beer-Lambert là một mối quan hệ huyền bí giữa độ hấp thụ, nồng độ của dung dịch, hệ số hấp thụ mol của nó và hệ số quang học trong dung dịch.
A = εLc
Ở đây,
- A là lượng ánh sáng được mẫu hấp thụ ở một bước sóng cụ thể
- ε là hệ số tắt mol
- L là khoảng cách ánh sáng đi qua dung dịch
- c là nồng độ của các loài hấp thụ
Hệ số hấp thụ của mol là một tính chất phụ thuộc vào mẫu đo mức độ hấp thụ của mẫu khi nói đến bước sóng mà nó có. Nồng độ là một mol (M) trong dung dịch của chất hòa tan trong dung dịch. nó được đo bằng chiều dài của cuvette được sử dụng để đo độ hấp thụ, thường là 1 cm.
2. Phương trình định luật beer lambert
Định luật Beer có thể được viết đơn giản là:
A = εbc
Trong đó
- A là độ hấp thụ (không có đơn vị)
- ε là hệ số hấp thụ mol với đơn vị L mol-1 cm-1 (trước đây gọi là hệ số tắt)
- b là chiều dài đường đi của mẫu, thường được biểu thị bằng cm
- c là nồng độ của hợp chất trong dung dịch, tính bằng mol L-1
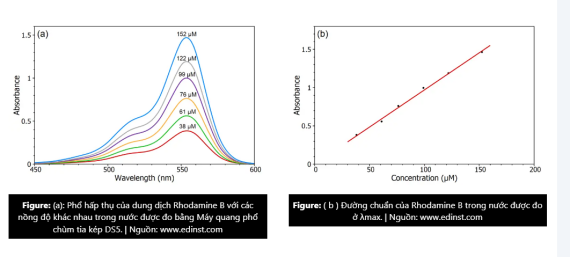
Phương pháp tính độ hấp thụ của mẫu bằng cách sử dụng phương trình dựa trên hai điều kiện:
- Nó tỷ lệ thuận với chiều dài của cuvette (chiều dài của cuvet).
- Nó tỷ lệ thuận với lượng chất đó.
Phương trình định luật Beer-Lambert như sau:
T = I0e-μ(x)
Ở đây,
- T là cường độ
- I0 là cường độ ban đầu
- μ là hệ số hấp thụ
- x là độ sâu tính bằng mét
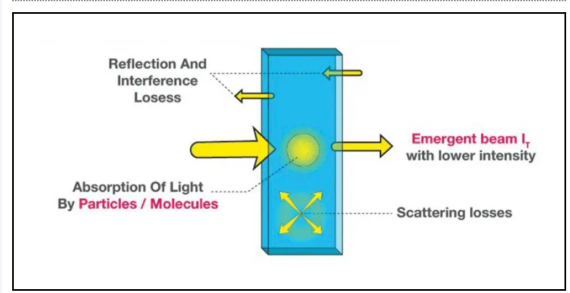
4. Làm thế nào để rút ra phương trình Luật Beer - Lambert? Nguồn gốc của Luật Beer - Lambert
Sự hấp thụ năng lượng gây ra sự hấp thụ ánh sáng cũng như thường là bởi các điện tử. Các dạng ánh sáng khác nhau như ánh sáng khả kiến và tia cực tím được hấp thụ trong quá trình này. Do đó, sự thay đổi cường độ ánh sáng do hấp thụ, giao thoa và tán xạ dẫn đến:
ΔI = I0 – N
Các phương trình sau đây là cần thiết để chúng ta có được phương trình đạo hàm cuối cùng. Độ truyền qua được đo bằng tỷ lệ ánh sáng truyền qua một chất. Nó có thể được tính là IT/I0. Để tính tỷ lệ phần trăm truyền qua, chúng ta có thể làm như vậy bằng cách:
%T = 100Ir/I0
Phần trăm truyền qua Một số liệu quan trọng khác là độ hấp thụ được định nghĩa là lượng ánh sáng được hấp thụ. Điều này thường được tính là âm của độ truyền qua và được cho bởi:
Độ hấp thụ (A) Tốc độ giảm cường độ ánh sáng theo độ dày của vật liệu chiếu sáng tỷ lệ thuận với cường độ ánh sáng tới. Về mặt toán học, nó có thể được biểu diễn như sau:
As k' = Hằng số tỷ lệ
Lấy nghịch đảo của phương trình chúng ta nhận được,
Tích phân phương trình trên ta cũng được
Trong phương trình trên, b và C là hằng số tích phân và IT là cường độ được truyền ở độ dày
Để giải phương trình trên với hằng số tích phân, sau đó chúng ta nhận được,
Trong khi giải C trong phương trình sẽ cho chúng ta,
Chuyển đổi sang log10 chúng tôi nhận được,
Sắp xếp lại phương trình ta được A = K'b/2.303
Vì vậy, định luật Lambert đã được tạo ra và tuyên bố rằng bức xạ đơn sắc tăng theo cấp số nhân và giảm khi nó đi qua một môi trường có độ dày đồng nhất.
Điều này kết thúc sự dẫn xuất của luật Beer-Lambert. Điều này chứng tỏ rằng, để tạo ra một định luật chính xác, có rất nhiều phương trình phải được tìm ra trước khi đạt được kết quả mong muốn.
5. Các ứng dụng của Luật Beer-Lambert
5.1 Ứng dụng trong Hóa phân tích
Nghiên cứu này tập trung vào việc phân tách, định lượng và mô tả đặc tính của vật chất thông qua phép đo quang phổ. Nó không yêu cầu quá trình tiền xử lý mẫu kéo dài để thu được kết quả. Ví dụ, số lượng bilirubin trong các mẫu máu có thể được đo bằng cách sử dụng máy đo quang phổ.
5.2. Ứng dụng Trong khí quyển
Bức xạ mặt trời hoặc sao xảy ra trong lớp khí quyển có thể được mô tả bằng định luật này. Luật áp dụng cho các ứng dụng khí quyển là một phương trình thay đổi:
Ở đây,
- a là sol khí
- g là khí hỗn hợp
- RS là hiệu ứng tán xạ Raman.
- NO2 là Nitơ điôxit
- w là sự hấp thụ hơi nước
- O3 là Ozon
- r là tán xạ Rayleigh
6. Hạn chế của Luật Beer-Lambert
Tính tuyến tính trong định luật Beer-Lambert bị ảnh hưởng bởi các nguyên nhân hóa học và công cụ. Một số nguyên nhân của sự phi tuyến tính là
- Hệ số hấp thụ bị ảnh hưởng bởi độ lệch ở nồng độ cao hơn (> 0.01M) do tương tác tĩnh điện giữa các phân tử ở gần nhau
- Tán xạ ánh sáng gây ra bởi các hạt trong mẫu
- Huỳnh quang hoặc lân quang trong mẫu
- Thay đổi chiết suất ở nồng độ chất phân tích cao
- Sự thay đổi cân bằng hóa học liên quan đến nồng độ
- Bức xạ không đơn sắc được giảm thiểu bằng cách sử dụng một phần phẳng của quang phổ, giống như điểm cao nhất trong quang phổ hấp thụ
- Đèn đi lạc
Việc làm dành cho sinh viên:
Việc làm gia sư môn Hóa Học mới nhất
Việc làm gia sư các môn cập nhật theo ngày mới nhất
Việc làm thêm nhân viên phục vụ nhà hàng/ quán cafe dành cho sinh viên
Mức lương của gia sư môn Hóa học là bao nhiêu?
Việc làm cộng tác viên Hóa dược





